Les travaux de Jacques Monod en ce milieu de XXe siècle portent sur la croissance de colonies de la bactérie Escherichia coli. En particulier, il s’intéresse à la protéine qui catalyse l’hydrolyse du lactose, prélude nécessaire au catabolisme du fructose et du galactose, les sucres simples associés dans la molécule de lactose (voir ici article Jacques Monod et sa protéine fétiche). On observe que tant que le lactose n’est pas présent dans le milieu, il n’y a pas de bêta-galactosidase, celle-ci ne faisant son apparition qu’avec un certain délai après l’introduction du lactose.
Pour expliquer ce fait, on dispose alors depuis 1930 de la théorie de l’adaptation enzymatique.
L’adaptation enzymatique
Cette théorie articule deux éléments :
- La thèse du précurseur qui suppose l’existence de deux formes de l’enzyme ; l’une appelée le précurseur, inactif, et l’autre qui serait la forme active ;
- La thèse du modelage, le substrat ayant une action directe sur le précurseur qui se moulerait en quelque sorte sur lui pour devenir l’enzyme active.
Nous sommes alors tout juste après la fin de la Seconde Guerre Mondiale. Monod est encore marqué par l’essor de la biochimie qui a démarré à la toute fin du XIXe siècle et s’est développée surtout autour des protéines dans la première moitié du XXe siècle. L’analogie mécaniste de la clé et de la serrure, proposée par Fischer dès 1890, encore acceptée de nos jours, a marqué les esprits : le substrat s’encastre dans une zone précise de l’enzyme, appelée site enzymatique, sans que l’on sache bien si ce site est complètement préformé (thèse aux relents de vitalisme dont se méfie Monod), ou s’il s’adapte, autrement ajuste sa forme à celle du substrat.
La théorie du modelage s’accorde bien avec les travaux d’alors en immunologie. Découverts au début du XXe siècle, les anticorps sont des protéines appelées immunoglobulines. Lorsqu’un antigène (motif moléculaire étranger, par exemple issu d’un microbe) entre en contact avec un organisme développé de type Vertébré, ce dernier fabrique en réponse un anticorps pour neutraliser l’antigène et empêcher ou réduire ainsi ses effets éventuellement pathogènes.
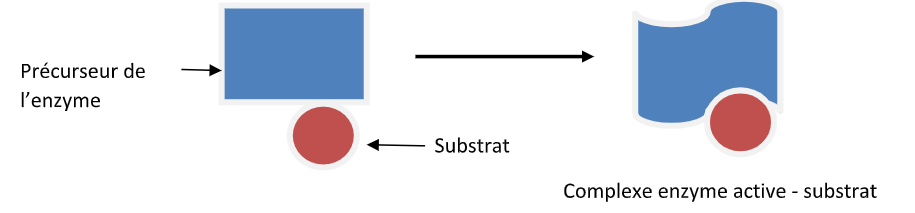
Cette neutralisation résulte de la formation d’un complexe anticorps-antigène, lequel est ensuite éliminé. L’antigène se fixe donc sur l’anticorps, comme une clé entre dans une serrure. Or, les anticorps sont spécifiques des antigènes, ce qui suggère que la clé et la serrure se correspondent parfaitement : cette correspondance ne laisse pas d’étonner. Aussi Pauling dans les années 1940 a suggéré la flexibilité conformationnelle de la zone de fixation de l’antigène sur l’immunoglobuline. Ainsi l’antigène ferait lui-même son « trou », imposant un changement de forme du site pas encore spécifique de la protéine. La protéine anticorps viendrait se modeler autour de l’antigène pour acquérir sa forme définitive, comme si la serrure était achevée en fonction de la clé (voir figure 1).
Fig.1 Adaptation enzymatique par modelage
De la même façon, on imagine que le lactose se fixe sur la protéine précurseur (inactif) selon le principe clé-serrure, ce qui entraîne un changement de la forme de la protéine qui devient active, en l’occurrence ici la bêta-galactosidase capable de catalyser l’hydrolyse du lactose. Mais Monod commence à douter, et il va bientôt mettre en jeu la génétique. Pourquoi ?
On a vu que Monod faisait varier les sources de nourriture. Or le comportement des bactéries vis-à-vis des divers sucres testés dépend de la souche bactérienne, chacune étant issue d’une mutation de la souche sauvage. Il est établi à cette époque par la génétique que les mutations correspondent à des modifications du génome (ensemble des gènes portés par les chromosomes). Pour simplifier, le cas le plus courant connu alors est celui de la mutation qui affecte un gène donné. Soit le gène désigné par X, sa variante ou allèle sauvage sera notée X+. Et sa variante mutée (allèle muté) est notée selon les cas X- ou X tout court. Assez souvent, les gènes sont désignés par une lettre ou un groupe de lettres qui rappellent le caractère dans sa version mutante.
De la même façon, on imagine que le lactose se fixe sur la protéine précurseur (inactif) selon le principe clé-serrure, ce qui entraîne un changement de la forme de la protéine qui devient active, en l’occurrence ici la bêta-galactosidase capable de catalyser l’hydrolyse du lactose. Mais Monod commence à douter, et il va bientôt mettre en jeu la génétique. Pourquoi ?
On a vu que Monod faisait varier les sources de nourriture. Or le comportement des bactéries vis-à-vis des divers sucres testés dépend de la souche bactérienne, chacune étant issue d’une mutation de la souche sauvage. Il est établi à cette époque par la génétique que les mutations correspondent à des modifications du génome (ensemble des gènes portés par les chromosomes). Pour simplifier, le cas le plus courant connu alors est celui de la mutation qui affecte un gène donné. Soit le gène désigné par X, sa variante ou allèle sauvage sera notée X+. Et sa variante mutée (allèle muté) est notée selon les cas X- ou X tout court. Assez souvent, les gènes sont désignés par une lettre ou un groupe de lettres qui rappellent le caractère dans sa version mutante.
Un précurseur sans modelage ?
Il se trouve que Monod a participé en 1946 au congrès de Cold Spring Harbor aux USA, où il a pris connaissance des travaux sur la moisissure Neurospora de Beadle et Tatum. Ceux-ci en ont tiré l’hypothèse dite 1 gène 1 protéine, postulant que chaque protéine est sous la dépendance d’un gène particulier. Il est cependant trop tôt pour que l’esprit de Monod soit prêt à admettre ce lien, au moins pour « sa chère » β-G-ase et sa non moins chère Escherichia coli. En outre, cette hypothèse ne permet pas encore d’envisager une étude expérimentale. Pourtant, le phénomène de diauxie le fait réfléchir (lire ici article Jacques Monod et sa protéine fétiche).
Il faut supposer que tout se passe comme si les bactéries « ignorent » au départ l’un des deux sucres : quand le premier est consommé, la croissance s’arrête comme s’il n’y avait plus de nourriture disponible ; et il faut un délai pour que la croissance reparte, le temps que les bactéries s’attaquent au deuxième sucre. On ne comprend guère ce délai si les enzymes s’adaptent mécaniquement à leur substrat : elles ont eu le temps de le faire dès le contact initial avec les deux sucres apportés en même temps dans le milieu de culture.
Que doit faire Monod : renoncer à la théorie en vigueur même si on ne dispose pas d’une de substitution ? Les scientifiques y répugnent en général et, la science ayant elle aussi « horreur du vide », il va se résoudre à chercher les preuves expérimentales qui manquaient jusqu’ici à l’adaptation enzymatique. Délaissant la question physicochimique du modelage, il va s’employer à identifier le précurseur de sa β-G-ase. Car entre-temps, la technique biochimique a permis d’isoler, de purifier et de caractériser les enzymes contenues dans les cellules.
En 1952, Monod parvient à purifier la bêta-galactosidase. Il fait alors produire à un animal des anticorps dirigés contre elle. Avec ces anticorps, il pense avoir réussi à mettre en évidence le fameux précurseur – nommé protéine Pz – présent selon lui dans la cellule avant l’addition du lactose et dont la quantité semblait bien diminuer après son introduction dans le milieu. Ouf ! La théorie semble sauvée. Or, un autre résultat expérimental obtenu par la petite équipe dirigée par Monod va mettre sérieusement en péril la thèse du modelage.
L’équipe utilise une souche de bactérie mutante qui diffère de la souche sauvage par son incapacité à fabriquer un certain acide aminé. Autrement dit, la bactérie sauvage survit dans le milieu minimal composé de sels minéraux plus la source de sucre, ici le lactose. Tandis que la souche mutante a besoin du milieu minimal complémenté par l’acide aminé qu’elle ne sait pas fabriquer, plus le lactose.
Les expériences conduites par l’équipe de Monod avec ce matériel font douter de la thèse du modelage. Nous voici donc devant une bizarrerie : le précurseur de la bêta-galactosidase existerait, mais sans pouvoir se modeler sur son substrat. Monod parvient quand-même à trouver une explication qui préserve la théorie. Mais dans son équipe, ça discute, et l’on se demande s’il ne serait pas judicieux d’utiliser la nouvelle technique du marquage radioactif, ayant fait son apparition aux USA dès 1940.
Un nouvel outil, le marquage radioactif
L’équipe décide alors d’ajouter au milieu de culture de la souche mutante un acide aminé marqué par un isotope radioactif. Nous sommes en 1953 et en France. Or, les laboratoires de recherche y sont encore bien mal équipés. Il faut plusieurs mois pour monter, avec des pièces détachées récupérées, un compteur Geiger (qui mesure la radioactivité) que le labo ne possède pas. Mais le résultat est sans appel : la β-G-ase isolée à partir de la culture contient toute la radioactivité.
La thèse du précurseur est ruinée et avec elle tout l’édifice de l’adaptation enzymatique. Il faut admettre que, en réponse à l’adjonction de lactose dans le bouillon de culture, la cellule se met à fabriquer de novo de la β-G-ase par incorporation des acides aminés (dont celui qui est radioactif). Autrement dit, le lactose induit la production de β-G-ase. Le lexique marque ici la rupture : de l’adaptation on passe à l’induction enzymatique, selon l’expression proposée par Monod en 1953.
Assiste-t-on juste à un changement de vocabulaire ? En tout cas il va donner une orientation nouvelle aux recherches pour élucider le mécanisme de cette induction, qui ne peut plus être l’adaptation enzymatique au sens d’un précurseur que le lactose modifierait de façon mécanique ou physicochimique directe. Mais dans quelle direction aller ? Deux voies sont alors envisagées pour cette induction :
- Ou bien l’induction enzymatique est un processus de nature néo-lamarckienne. Le lactose provoque la fabrication de la β-G-ase parce qu’il est son substrat. L’explication est, on le voit, purement verbale, mais évacue le modelage mécanique de la théorie de l’adaptation enzymatique, sans processus de substitution. Cela reste assez flou.
- Ou bien la β-G-ase serait en quelque sorte pré-modelée, sa forme comporterait d’emblée le site enzymatique complémentaire de la molécule de lactose. Osons le dire, elle serait préformée, au risque du vitalisme, dûment récusé par Monod. Il ne reste pas d’autre issue que d’explorer l’intervention des gènes, selon une option génétique et darwinienne.
Le dilemme va s’avérer cornélien pour Monod et son équipe. Car l’option néo-lamarckienne résiste mal au courant darwinien qui commence à dominer la biologie depuis l’avant-guerre, et ce d’autant plus que cette option n’offre pas de mécanisme concret. Tandis que la préformation est emprunte d’un relent vitaliste largement condamné par les milieux scientifiques les plus pointus. Dans ces conditions, comment en est-on arrivé à l’idée d’impliquer des gènes ? Pour cela, il va nous falloir ouvrir une longue parenthèse en abordant la longue histoire qui a mené de la génétique à la biologie moléculaire. Plusieurs épisodes seront à suivre.
Bibliographie
Patrice Debré, Jacques Monod, Flammarion, 1996.
Michel Morange, Histoire de la biologie moléculaire, La Découverte, 1994.