La bactérie Escherichia coli se nourrit ordinairement de sucres. Lorsqu’on la nourrit de lactose, celui-ci est hydrolysé dans la cellule grâce à une enzyme nommée bêta-galactosidase (en abrégé β-G-ase). Cette hydrolyse est un préalable à l’oxydation complète des molécules de sucres, fournisseur de l’énergie nécessaire au fonctionnement de la cellule, car le lactose est un sucre dit en C12 (12 atomes de carbone) qui doit être d’abord scindé en ses deux sucres en C6 constitutifs. Or un double fait intrigue Jacques Monod : sans lactose dans le milieu, la β-G-ase n’est pas présente dans la bactérie ; lorsqu’on ajoute le lactose, il faut un certain délai pour que la β-G-ase apparaisse.
Ce fait pourrait suggérer que l’enzyme est fabriquée exprès lorsque le lactose est introduit dans le milieu de culture. Monod reste toutefois très prudent car cette explication se heurte à la théorie alors en vigueur ainsi qu’aux conceptions encore rudimentaires sur le métabolisme cellulaire. On sait alors que la catalyse enzymatique implique la fixation du substrat (ici le lactose) sur un site spécifique de la protéine, selon un modèle clé-serrure suggéré par le biochimiste allemand Emil Fischer dès 1890 et toujours accepté.
Autrement dit, le site enzymatique a une forme complémentaire de celle du substrat dont il va permettre la transformation chimique (ici l’hydrolyse du lactose). Mais à quoi est due cette complémentarité ? On l’ignore à l’époque et il semble alors inimaginable que l’enzyme puisse être fabriquée en réponse à l’arrivée du substrat qu’elle va catalyser, et donc avec un site de fixation ayant la forme appropriée.
Adaptation ou-préadaptation ?
En effet, plutôt que de considérer que l’enzyme soit fabriquée de novo en intégralité à la suite de l’arrivée du lactose, on préfère une solution bien plus simple. Le site catalytique de la protéine n’a pas d’emblée une forme complémentaire à celle de son substrat et c’est à l’arrivée de celui-ci à proximité que le site devient complémentaire. On postule un processus mécanique ou physicochimique qui amène la protéine, au contact de la molécule qu’elle doit capturer, à se reconfigurer, au moins localement, pour adopter la forme appropriée. C’est la théorie de l’adaptation enzymatique, dont l’appellation est proposée en 1930 par le finlandais Henning Karström.
Cette explication satisfait l’esprit rationnel. Elle s’accorde en outre avec ce l’on croit à l’époque être l’explication de la diversité des anticorps (dont la nature protéique a été établie) et de leur parfaite complémentarité à la non moins impressionnante collection d’antigènes. Le biophysicien Linus Pauling en 1940 postule en effet la flexibilité conformationnelle de la zone de fixation de l’antigène sur l’anticorps. On imagine très sérieusement que tout se passe comme si la serrure (le site) se modelait sur la clé (le substrat) censée la manœuvrer, ou, ce qui revient presque au même, comme si la clé modifiait la serrure directement, mécaniquement, la forçait en quelque sorte pour que celle-ci puisse être manœuvrée.
Quid alors des arguments qui intriguent Monod : l’absence de la β-G-ase dans la cellule non nourrie au lactose, et le délai de son apparition ? On peut toujours rétorquer qu’il faut bien un certain temps pour que la protéine reconfigure son site catalytique. Quant à son absence, on peut supposer qu’elle n’est qu’une apparence, puisque, tant que le lactose est absent du milieu, l’enzyme se trouverait sous une conformation inapte à assurer son hydrolyse, ce qui la rend indétectable puisque inactive.
Si en revanche on retient l’idée que l’enzyme est proprement fabriquée de novo à la suite de l’arrivée du lactose, il faut admettre dans ce cas que l’enzyme est pré-adaptée à la forme de son substrat. Le site actif de la protéine est d’emblée complémentaire du substrat pour que celui-ci vienne s’y encastrer et que la catalyse puisse avoir lieu. Un point de vocabulaire mérite d’être fait à ce stade. L’adaptation enzymatique aurait pu être nommée accommodation, selon l’usage des naturalistes, s’agissant d’une modification directe et conjoncturelle sous l’action du milieu. Si bien que la préadaptation aurait pu être simplement appelée adaptation au sens des naturalistes, savoir une forme ou une fonction d’emblée adaptée à l’environnement.
Vitalisme ou mécanicisme ?
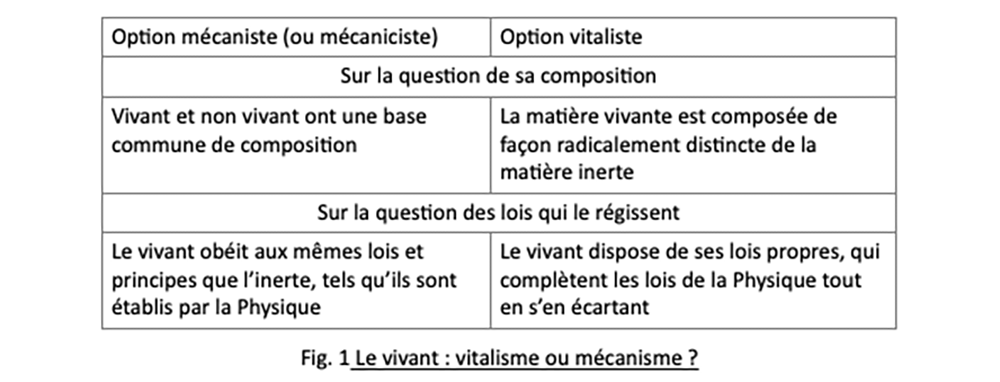
Ici l’esprit rationnel se satisfait de la thèse de l’adaptation-accommodation. Mais en quoi la thèse opposée de l’adaptation-préadaptation peut-elle le déranger ? L’existence de toute matière intrigue probablement depuis l’aube de l’humanité, et le vivant constitue sans doute une énigme encore plus grande. Pour ainsi dire depuis l’Antiquité on oscille entre deux façons de le considérer dans son rapport au reste de la matière. Le tableau ci-dessous (voir figure 1) résume le débat de façon simplifiée.
Le vitalisme, dont l’essor se déroule au XVIIIe siècle, a représenté une façon de s’émanciper d’une mécanique un peu grossière, à la façon de l’animal-machine de Descartes au XVIIe siècle, incapable de rendre compte des propriétés originales du vivant, en particulier la reproduction et le métabolisme. Avec ses slogans bien connus – le vivant ne peut naitre que du vivant, et le vivant ne peut se nourrir que du vivant – il demeure une affirmation, un dogme incapable de fournir les moyens de sa mise à l’épreuve. Il est même contredit dans la question nutritive par le cas des végétaux verts, quoique l’élucidation de cette question ait été tardive, au XIXe siècle.
D’un autre côté, les progrès et la sophistication des diverses branches de la Physique, à partir de la fin du XIXe siècle, ont permis de consacrer le triomphe du physicalisme, version moderne du mécanisme. Ce qui explique que la rationalité a penché de ce côté. Ainsi dans l’affaire de la β-G-ase, quoi de plus « naturel », rationnel, que de considérer que des processus physicochimiques suffisent à modifier la forme de la protéine pour qu’elle s’accommode (ou s’adapte) à son substrat.
Pourtant cette question de la forme dépasse très largement le cas de la complémentarité des sites de fixation des protéines envers leurs substrats, qui n’en est qu’une illustration parmi tant d’autres. Y consacrer un petit développement aidera à comprendre dans quel état d’esprit Jacques Monod aborde les problèmes auxquels il se trouve confronté lors de ses recherches sur les liens entre lactose et bêta-galactosidase.
Le problème de la forme
Le problème de la forme correspond en effet à l’énigme de l’établissement, du maintien et éventuellement de la transmission de toutes les structures : dit autrement, pourquoi la matière est-elle structurée, a-t-elle une forme, et d’où cela vient-il ? Ce problème n’est pas spécifique du vivant, il concerne la matière en général, comme l’avaient souligné les penseurs de la Grèce antique.
Appliquée au vivant, l’énigme de la forme reçoit des tentatives de solutions dès l’Antiquité. Voici l’option d’Aristote : le vivant est doté d’une âme singulière (terme pris ici dans un sens non spiritualiste), consubstantielle de sa matière, non extérieure à elle, qui assure ses diverses fonctions par autant d’âmes spécifiques : la végétation (nutrition, croissance et développement) ; la génération (reproduction) ; l’intellection (pensée, psychisme), etc. L’explication est certes purement verbale, mais affirme l’autonomie du vivant, laquelle saute aux yeux. L’âme est, pour Aristote, ce qui informe (=donne sa forme à) la matière. Il distingue en effet pour l’ensemble du monde une matière en quelque sorte fondamentale, sans structure, amorphe, de la matière informée, autrement dit structurée par diverses âmes particulières. Cette conception le conduit à considérer que la construction de l’être vivant obéit à un but, selon un projet lui-même inscrit dans sa matière informée. Cette téléologie ou finalisme est issue des quatre causes qu’il a distinguées pour rendre compte des phénomènes tant naturels qu’artificiels : cause matérielle (le matériau) ; cause efficiente (les actions exercées sur le matériau) ; cause formelle (forme donnée au matériau) ; cause finale (usage, fonction, et par conséquent projet).
L’animisme d’Aristote s’accorde au fond avec l’option vitaliste qui s’est presque imposée au cours du XVIIIe siècle et qui soutient la distinction radicale entre physique et biologie. Or en ce milieu du XXe siècle où Monod effectue ses recherches, la Physique tient le haut du pavé et s’y oppose farouchement : les biologistes sont sommés de suivre. S’il y a bien des causes qui déterminent les phénomènes, elles sont externes. Il n’y a point de causes finales, et Monod défend fermement ce point de vue. Le but, le résultat, ne saurait diriger la construction du monde, vivant inclus. Il n’y a que des causes efficientes ou agissantes, au risque que ce déterminisme strict ne laisse aucune place à l’imprévision et à l’inattendu.
L’option mécaniciste vivifiée par ce physicalisme se concentre sur, d’autres diraient se limite au comment des processus naturels : leur description toujours plus fine et leur enchainement, causal. Ce qui ne permet pas d’expliquer l’autonomie du vivant, lequel s’établit, se maintient et se transmet à la génération suivante. Et encore moins son origine première. Sauf à considérer qu’il est façonné de l’extérieur, option spiritualiste, donc non scientifique, et partant incompatible autant avec le mécanicisme qu’avec le vitalisme.
Jacques Monod se trouve ainsi pris dans ce dilemme. Récusant tout finalisme et tout vitalisme, il mettra quelques années à s’affranchir de l’explication mécaniste de la modification de la forme de la protéine par l’action directe de son substrat. Car au moment où il démarre ses recherches sur le lien entre le lactose et la bêta-galactosidase, une autre explication est encore inconcevable, car la Physique semble l’interdire. Toutefois un autre motif, plus circonstanciel, freine notre chercheur : le risque de donner raison au savant soviétique Lyssenko que Monod combattit avec force.
Références
Aristote, Histoire des animaux – Traduction, présentation et notes par Janine Bertier, Folio Gallimard, 1994.
Patrice Debré, Jacques Monod, Flammarion, 1996.
Dominique Lecourt (Dir.), Dictionnaire d’histoire et de philosophie des sciences, PUF, 1999.
Patrick Dupouey, Épistémologie de la biologie, Nathan Université, 1997.
Yves Zarka (avec la coll. de Germain M-F), Buffon, le naturaliste philosophe, Chemins de tr@verse, 2013.